5月11日,深圳理工大学(筹)药学院/中国科学院深圳先进技术研究院王崇元团队与徐州医科大学张赭团队合作,在期刊Nature Communications上发表了题为Structural insights into drug transport by an aquaglyceroporin的研究论文。(点击文末“阅读原文”阅读论文)研究首次揭示了水通道蛋白介导药物转运的分子机制,为新型药物的研发提供了新思路。
布氏锥虫(Trypanosome)是引起人类昏睡病和动物锥虫病的病原微生物。喷他脒(pentamidine)和美拉砷醇(melarsoprol)作为锥虫病的治疗药物已有超过70年的历史,并且目前仍在使用。与大多数药物不同,喷他脒并非通过抑制锥虫体内特定蛋白靶点,而是通过结合DNA来抑制复制和翻译过程来达到杀虫作用。因此,只有药物在锥虫体内积累到几个毫摩尔的浓度才能起到杀虫作用。锥虫水通道AQP2(TbAQP2)对喷他脒和美拉胂醇的吸收和富集起到关键作用,其基因突变是导致交叉耐药的首要原因。美拉砷醇和喷他脒的尺寸远大于水通道的常规底物,其分子量是水分子的20倍、甘油的4倍。TbAQP2也是目前被报道的唯一具有药物转运功能的水通道蛋白,其背后的分子机制困扰着领域多年。
为了以更简便快速的方式研究TbAQP2的转运活性,研究团队使用喷他脒的荧光类似物作为底物,开发了基于HEK293细胞的转运实验,在哺乳动物细胞中实现了TbAQP2的药物转运功能重构。实验显示TbAQP2在哺乳细胞中也表现出极高的效率,可以在1分钟内把药物转运至胞内,证实TbAQP2在哺乳细胞内也表现出药物转运功能。在功能分析的同时,研究团队利用Bac-Mam体系表达,并通过脂纳米盘技术纯化得到了TbAQP2蛋白。随后,利用单颗粒冷冻电镜技术成功解析了TbAQP2无底物状态的结构,分辨率为3.2埃。TbAQP2主体结构展现出经典的四聚体水通道模式,通过结构分析,相比于转运水、甘油等小分子量底物的水通道蛋白(如人源AQP1、AQP4等),TbAQP2的跨膜通道明显大一些,使其转运药物等大分子量的底物成为可能。
为了进一步揭示药物转运的分子机制,研究团队又成功解析了TbAQP2与喷他脒、美拉胂醇结合的复合物结构,分辨率为2.4埃。高质量的电镜密度使我们可以直接观察到喷他脒和美拉胂醇结合的位点以及相互作用的氨基酸,并通过突变和转运分析验证了这些氨基酸的重要性。虽然喷他脒和美拉胂醇的结构式存在显著差异,但它们都以伸展的构象结合在TbAQP2跨膜通道中。然而,它们的高亲和力结合位点并不重叠,喷他脒位点靠近胞内区,而美拉胂醇位点靠近胞外区。这两种底物主要通过疏水相互作用与氢键与跨膜通道结合,TbAQP2通过对底物形状的识别和特定基团的结合来实现特异性转运。这些结构信息为基于TbAQP2跨膜通道设计新型昏睡病治疗药物奠定了基础。
此外,为了进一步探究药物分子的转运途径,研究团队对TbAQP2-喷他脒复合物进行了分子动力学模拟分析。在模拟的时间尺度中,可以清晰地观察到喷他脒分子沿TbAQP2通道转运进入细胞,同时还发现喷他脒转运过程具有膜电位依赖性,这与之前的锥虫实验观察结果一致。
总之,本研究通过结构生物学、细胞生物学及分子动力学模拟等实验手段首次揭示了水通道蛋白介导药物转运的分子机制为新型药物的研发提供了新思路。

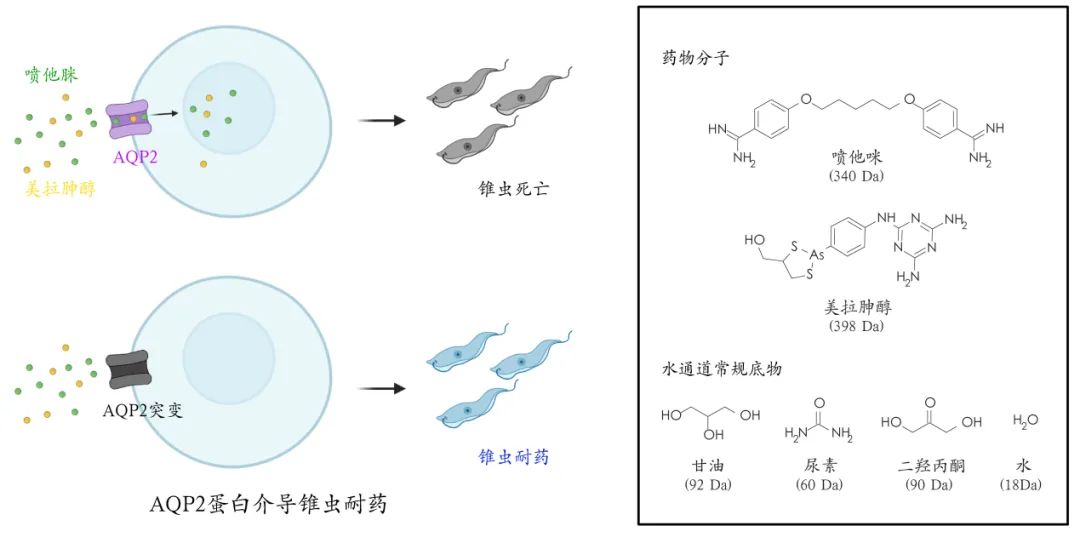
TbAQP2介导药物转运,是锥虫耐药的关键基因
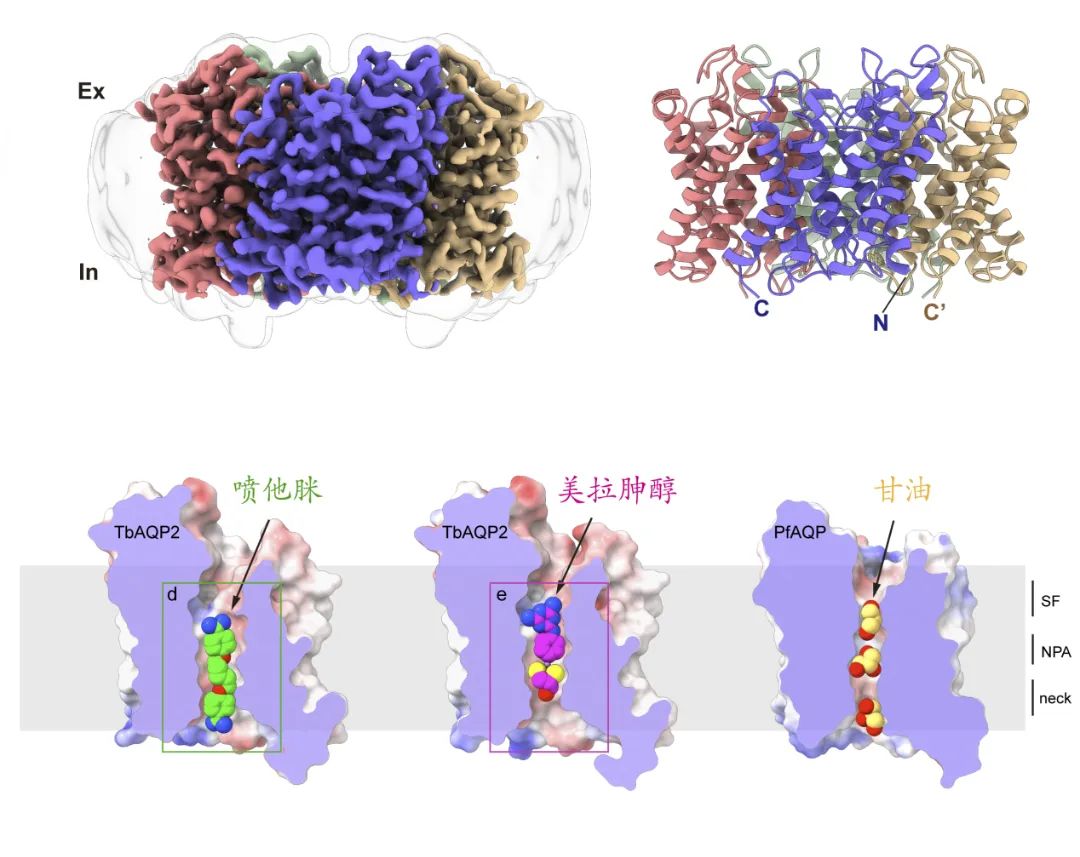
底物识别与转运的分子机制
阅读原文
